Um mercado global de 112 bilhões US$ (2018)
Interfarma / IQVIA
David Peig , Rachel Keller, Wagner Gonçalves
Novembro de 2021
A IMPORTÂNCIA DA PESQUISA CLÍNICA PARA O BRASIL DEZEMBRO DE 2021 ATUALIZAÇÃO
Editado por
Joaquim Cardoso MSc.
The Health Revolution
Institute for Research and Strategy — to Better Health for All
27 de Maio de 2022
Conceitos básicos da pesquisa clínica
O desenvolvimento de novos medicamentos percorre uma extensa investigação científica, que começa nas pesquisas em laboratório, segue para estudos em animais e por fim, em seres humanos, realizados em três fases, para que depois a terapia seja produzida e comercializada.
Agências reguladoras ao redor do mundo desenvolveram regulamentação e processos específicos para estudos clínicos visando garantir a segurança do novo tratamento para os seres humanos desde seu desenvolvimento até sua comercialização, incluindo etapas posteriores de monitoramento pós-lançamento do medicamento, para manter a vigilância sobre seus efeitos.
Estágios e fases do desenvolvimento de um tratamento inovador
O desenvolvimento de um tratamento inovador pode ser dividido em três grandes estágios de pesquisa: básica, não clínica e clínica.
- A pesquisa básica procura identificar compostos e moléculas promissoras para o tratamento de uma doença. Neste estágio, muitos compostos são investigados e parte relevante da pesquisa é realizada em universidades, instituições e fundações de pesquisa.
- Os compostos que se mostram ativos continuam a ser pesquisados e, assim, prosseguem para o estágio de desenvolvimento do medicamento, por meio do início dos estudos não clínicos. São realizados, então, testes in vitro e em animais (in vivo) de acordo com as diretrizes e normas éticas em pesquisa, com o objetivo de avaliar os parâmetros de segurança e eficácia do novo composto.
- A pesquisa clínica é o estágio final e o mais demorado, exigindo mais investimentos. Os compostos que apresentaram resultados positivos na pesquisa não clínica são testados quanto à eficácia e segurança em seres humanos. Somente com os resultados dos estudos clínicos é possível obter informações completas sobre o possível tratamento inovador e, desta forma, obter a aprovação junto aos órgãos reguladores para a sua comercialização.
A importância da pesquisa clínica pode também ser vista pela representatividade que ela possui dentro do investimento total em Pesquisa & Desenvolvimento (P&D).
Relatório da International Federation of Pharmaceutical Manufacturers & Associations (IFPMA)[1] apontou que 65% do investimento em P&D nos EUA, em 2014, foi direcionado para a pesquisa clínica (Figura 6).
… 65% do investimento em P&D nos EUA, em 2014, foi direcionado para a pesquisa clínica
Figura 6: Importância da pesquisa clínica no investimento total em P&D nos EUA (2014)
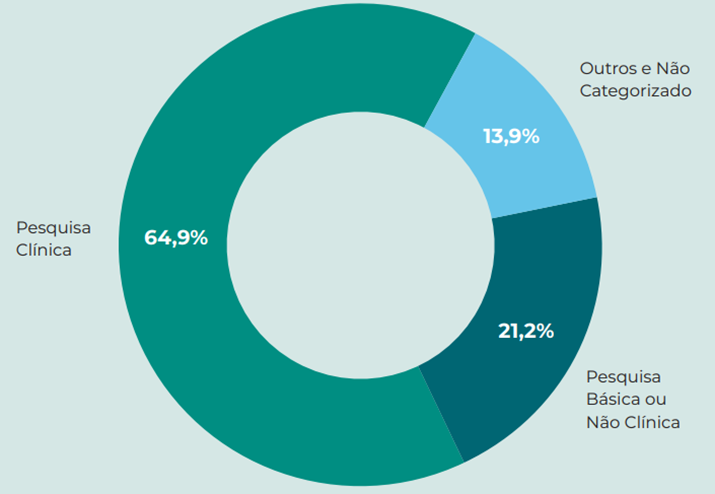
Fonte: IFPMA — The pharmaceutical industry and global health — Facts and figures 2017[2]
Utilizando esta mesma proporção sobre o investimento global em P&D mencionado anteriormente (US$ 172 bilhões), chegamos à estimativa do investimento direto em pesquisa clínica em todo o mundo, que é de US$ 112 bilhões (Figura 7).
o investimento direto em pesquisa clínica em todo o mundo, que é de US$ 112 bilhões
Figura 7: Estimativa de investimento global em pesquisa clínica (US$ bilhões, 2018).
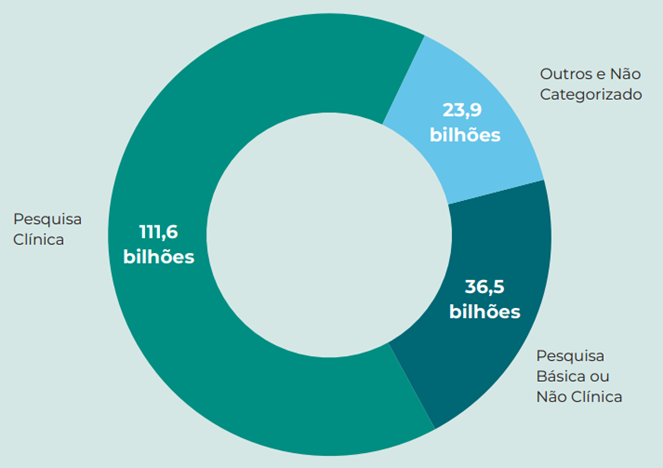
Fonte: IQVIA (estimativas internas)
Classificação das fases da pesquisa clínica (estudos clínicos)
Os estudos clínicos podem ser classificados em quatro fases[3], sendo que cada uma delas possui formatos e objetivos diferentes (ver Figura 8):
Figura 8: Classificação dos estudos clínicos.
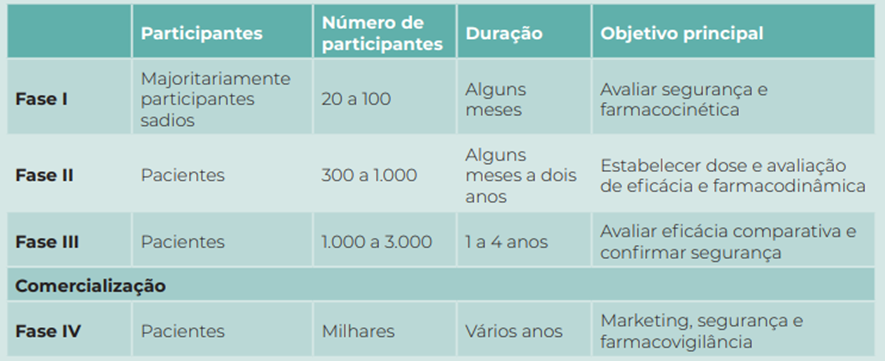
Fontes: IQVIA (dados internos), SBPPC (Sociedade Brasileira de Profissionais em Pesquisa Clínica)
- Fase I: visa entender aspectos relacionados à segurança e farmacocinética do medicamento, ou seja, as concentrações de um medicamento em uma ou mais regiões do organismo em relação à dose administrada[4]. É realizada, majoritariamente, em um número restrito de pacientes sadios.
- Fase II: busca avaliar a eficácia terapêutica do novo medicamento, agora em participantes doentes. O objetivo é estabelecer o perfil farmacodinâmico, isto é, os eventos consequentes à interação do medicamento com o local de ação[5], e a dose recomendada do novo tratamento, ou seja, a que alcance os melhores benefícios terapêuticos com o menor conjunto de reações adversas.
- Fase III: tem como objetivo avaliar o risco-benefício do tratamento, geralmente de maneira comparativa versus placebo ou utilizando outro tratamento de referência[6]. Geralmente possui centenas ou milhares de participantes portadores da doença.
- Fase IV: também conhecida como pesquisa pós-comercialização, é iniciada após a aprovação da agência reguladora para comercialização do produto. Nesta fase, os efeitos e reações adversas inesperadas do medicamento devem ser monitorados. Este processo de monitoramento, denominado farmacovigilância, é realizado pela empresa responsável pelo produto em conformidade com as respectivas normas sanitárias. Fluxograma geral de um estudo clínico O desenvolvimento de um projeto de pesquisa clínica (em qualquer uma das fases descritas acima) pode ser dividido em cinco etapas fundamentais: viabilidade, identificação do centro de pesquisa, submissão e aprovação ética/regulatória, início do estudo e, por fim, o seu encerramento. Para cada fase do processo são estabelecidas as tarefas e os prazos pertinentes à condução do estudo, e também são analisados criteriosamente os habilitadores críticos pertinentes a cada um deles, como descrito a seguir (Figura 9).
Fluxograma geral de um estudo clínico
O desenvolvimento de um projeto de pesquisa clínica (em qualquer uma das fases descritas acima) pode ser dividido em cinco etapas fundamentais: viabilidade, identificação do centro de pesquisa, submissão e aprovação ética/regulatória, início do estudo e, por fim, o seu encerramento. Para cada fase do processo são estabelecidas as tarefas e os prazos pertinentes à condução do estudo, e também são analisados criteriosamente os habilitadores críticos pertinentes a cada um deles, como descrito a seguir (Figura 9).
Figura 9: Fluxograma geral de um estudo clínico.

Inicialmente, avalia-se a viabilidade da condução de um estudo clínico em uma determinada região ou país, geralmente de acordo com aspectos econômicos (custos inerentes às fases do estudo) e epidemiológicos (incidência e prevalência da doença na população em questão).
Também são relevantes as seguintes questões: a experiência do país em estudos na indicação-alvo, a capacidade de recrutamento de participantes e a competitividade local nessa área de estudo (a fim de verificar a disponibilidade de pacientes).
Por fim, os protocolos atuais de tratamento da doença, especificidades da legislação e prazos de aprovação são essenciais para a tomada de decisão.
Uma vez que a condução do estudo clínico em uma determinada região é considerada viável, segue-se para a identificação do centro de pesquisa: é muito importante que os centros e seus respectivos investigadores possuam experiência com o tipo de estudo a ser desenvolvido, que o recrutamento de pacientes seja feito de forma rápida e eficaz, e que os custos do trabalho do centro estejam dentro do planejado. O histórico de excelência quanto ao desempenho e à qualidade dos serviços dos centros de pesquisa também é importante, juntamente com a acessibilidade necessária para o estudo em questão.
Em seguida, todas as informações éticas e sanitárias pertinentes ao estudo devem ser coletadas e enviadas às agências responsáveis pelas aprovações sanitárias e éticas.
Após parecer favorável, o medicamento em fase de teste poderá ser importado (quando necessário), dando-se início de fato ao estudo clínico.
Então, são realizadas as visitas de iniciação nos centros de pesquisa envolvidos, o treinamento dos seus funcionários e o recrutamento de pacientes.
Os pacientes são tratados segundo os protocolos aprovados e os dados são coletados, sendo essas atividades cruciais para que o estudo seja realizado dentro dos padrões éticos e sanitários aprovados.
O processo de recrutamento dos participantes da pesquisa clínica é fundamental para o sucesso de um novo tratamento e é regido por fortes padrões éticos definidos pelos agentes responsáveis em cada país.
Participantes de estudos clínicos assinam um termo de compromisso de participação denominado Termo de Consentimento Livre e Esclarecido (TCLE) e, antes de assiná-lo, o participante recebe todas as informações relativas à participação no estudo, seus objetivos e protocolos.
Após assinar o termo, o participante recebe toda a assistência necessária, por parte do patrocinador responsável pela pesquisa, como acompanhamento médico e reembolso de gastos referentes à participação no estudo.
Além disso, o voluntário pode se retirar da pesquisa no momento que desejar ou considerar necessário.
Ao fazer parte de um estudo clínico, o participante tem acesso a terapias inovadoras ainda não disponíveis no mercado, contribui para o desenvolvimento de novos tratamentos e para a melhoria da saúde pública.
As etapas finais de um estudo clínico são executadas após toda a condução do protocolo e coleta de informações.
Essas informações são organizadas em um banco de dados que é analisado via métodos estatísticos.
Relatórios finais sobre o resultado do estudo são produzidos e enviados às autoridades, com todas as informações arquivadas como disposto por lei.
Referências
[1] International Federation of Pharmaceutical Manufacturers & Associations- THE Pharmaceutical Industry and Global Health Facts and Figures 2017 https://www.ifpma.org/wp-content/uploads/2017/02/ IFPMA-Facts-And-Figures-2017.pdf. Acessado em 10 de Junho de 2019
[2] International Federation of Pharmaceutical Manufacturers & Associations- THE Pharmaceutical Industry and Global Health Facts and Figures 2017 https://www.ifpma.org/wp-content/uploads/2017/02/ IFPMA-Facts-And-Figures-2017.pdf. Acessado em 10 de Junho de 2019
[3] Terceirização da P&D de Medicamentos: Panorama do Setor de Testes Pré-Clínicos no Brasil — BNDES. Acessado em 10 de Junho de 2019https://www.bndes.gov.br/SiteBNDES/bndes/bndes_pt/Galerias/Convivencia/Publicacoes/Consulta_Expressa/Tipo/BNDES_Setorial/200903_04.html. Acessado em 10 de Junho de 2019
[4] J.M. Ritter, R. J. Flower, G. Henderson, H. P. H. Rang & Dale Farmacologia PDF. Available at: https://www. skoob.com.br/livro/pdf/rang-e-dale-farmacologia/livro:260696/edicao:291845. Acessado em 10 de Maio de 2019
[5] J.M. Ritter, R. J. Flower, G. Henderson, H. P. H. Rang & Dale Farmacologia PDF. Available at: https://www. skoob.com.br/livro/pdf/rang-e-dale-farmacologia/livro:260696/edicao:291845. Acessado em 10 de Maio de 2019
[6] History of Smallpox | Smallpox | CDC., https://www.cdc.gov/smallpox/history/history.html Acessado: 15 de fevereiro de 2019

Referências
Veja a publicação original
Lideranças
Hugo Nisenbom
Presidente do Conselho Diretor da INTERFARMA
Elizabeth de Carvalhaes
Presidente-executiva da INTERFARMA
Nilton Paletta
Presidente América Latina e Gerente-Geral Brasil da IQVIA
Sydney Clark
Vice-Presidente, RWAS and Technology da IQVIA
Fábio Franke
Presidente da Aliança Pesquisa Clínica Brasil
Rodrigo Guimarães
Diretor Vice-Presidente da IQVIA
ELABORAÇÃO IQVIA
David Peig | Gerente de Projetos
Willian Fujioka | Consultor Sênior
Fernanda Cardoso | Analista
Fernanda Rebelo | Estagiária
APOIO INTERFARMA
Wagner Gonçalves | Gerente de Comunicação
Ana Beatriz Rodrigues | Assessora de Imprensa
Cecília Soares | Analista de Comunicação
Nathália Arins | Designer Gráfico
DIRETORIA DE ASSUNTOS REGULATÓRIOS
Rachel Keller | Gerente
Priscila Carriel | Analista
PROJETO GRÁFICO E DIAGRAMAÇÃO
Nebraska Composição Gráfica
Originalmente publicado em https://www.interfarma.org.br
ARTIGOS RELACIONADOS